서 론
재료 및 방법
1. 식물 재료 및 재배환경
2. 이산화탄소 처리 및 UV-A 처리
3. 생육 특성
4. 광계II 최대 양자수율
5. 생리활성 화합물 측정
6. 통계처리
결과 및 고찰
1. 이산화탄소 처리와 UV-A 조사에 따른 케일의 생육 특성
2. 광계II 최대 광량자 수율(Fv/Fm)의 변화
3. 총 페놀 함량과 항산화도 및 개별적인 페놀 화합물의 변화
결 론
서 론
비생물학적 스트레스 요인 중 하나인 UV광은 일반적으로 UV-C(280nm 이하), UV-B(280-320nm), UV-A(320-390nm)의 세 가지 파장 범위로 분류된다. 이 중 UV-C광의 조사는 식물의 세포 구성 요소에 극심한 손상을 유도하지만, 오존 및 대기중의 가스들에 의해 대부분 흡수되기 때문에 지구 표면에 도달하지 않는다(Stapleton, 1992). 즉, 지구 표면에 도달하는 UV의 파장은 UV-B와 UV-A로 식물의 생장에 직접적으로 영향을 미치는 주요한 파장 범위라 할 수 있다.
UV-B 파장은 식물의 생화학적, 생리학적 및 형태학적인 반응을 유도함으로써 생장과 발육에 영향을 미치며(Frohnmeyer와 Staiger, 2003; Sharma와 Guruprasad, 2012), 높은 수준의 UV-B 광 조사는 활성 산소종(ROS)의 생성을 유발시켜 세포막, 단백질, DNA를 손상시키고 광합성 과정을 지연시켜 결과적으로 식물 생장에 악영향을 미친다(Müller 등, 2015; Vidović 등, 2015; Shayganfar 등, 2018). UV-A파장은 지구 표면에 도달하는 UV 범위의 95%를 차지하며, 식물 조직 내부까지 침투하기 때문에 높은 수준의 UV-A 조사는 고등 식물의 산화적 손상과 생장 억제를 유도할 수 있다(Krizek와 Chalker-Scott, 2005; Mumivand 등, 2021). 하지만, 낮은 수준의 UV-B와 UV-A조사는 1차 대사와 2차 대사 사이에서 탄소 대사 과정의 스위치를 변경할 수 있는 생리 생태적 요인으로 작용하여, 이로 인해 생산된 광합성 산물은 2차 대사로 방향이 전환된다(Ballaré 등, 2011; Caretto 등, 2015). 따라서, 잎 표면에 플라보노이드, 카로티노이드와 같은 UV-흡수 화합물과 산화적인 손상을 억제하는 항산화물질을 축적시킨다(Shirley, 1996). 더하여, 최근 연구에 따르면 UV-A 조사는 다양한 원예작물에서 항산화적 페놀릭 화합물을 유도할 뿐만 아니라 생장도 증대시킬 수 있다는 결과가 보고되고 있다(Brazaitytė 등, 2010; Lee 등, 2019; Choi 등, 2022).
UV 광조사에 대한 식물의 반응은 종(species)과 식물 생육단계에 따라 달라지며, 여기에는 식물 발달 과정에서 변화되는 식물의 해부학적, 생리학적, 형태학적 그리고 생화학적인 매개변수가 포함된다(Victorio 등, 2011). 식물 발달 과정 동안 생합성되는 2차 대사산물의 양적 그리고 질적 특성은 기본적으로 잎의 분화(differentiation)와 밀접하게 관련된 식물의 내부 요인에 의해 결정될 수 있다. 또한 식물 잎의 형태 및 해부학적 차이는 식물이 UV파장을 수광하는 정도의 차이를 유발하고 이로 인해 간접적으로 생합성 되는 2차 대사산물의 양적 및 질적 특성변화에 영향을 줄 수 있다(Victorio 등, 2011).
하지만 잎의 형태-해부학적 특징과 UV광 조사에 대한 식물의 2차 대사산물의 생합성 반응을 확인한 연구는 대부분 UV 광조사에 따른 탄소 동화물질의 분배(지질, 왁스, 큐티클, 탄닌 등)를 통한 보호 메커니즘과 관련된 연구(Schreiber 등, 2001; Bird와 Gray, 2003; Scotti-Campos 등, 2019; Bahamonde 등, 2023; Ofiti 등, 2023)가 대부분이다. 또한 잎의 형태적 특징 중 잎의 두께에 따른 식물 2차 대사산물 축적 변화와 관련된 연구는 거의 존재하지 않는다. 따라서 본 연구에서는 식물 잎의 형태 구조적인 측면, 특히 잎 두께에 따라 UV-A광 조사가 2차 대사산물 축적 패턴에 어떠한 영향을 미치는지 확인하였고, 더하여 UV-A광 처리 시간에 따른 2차 대사산물의 동적인 반응을 확인하였다.
재료 및 방법
1. 식물 재료 및 재배환경
케일(Brassica oleracea var. acephala ‘Manchoo Collard’) 종자(Asisa Seed, Seoul, Korea)를 종자 성장팩(Usem instrument, Suwon, Korea)에 파종 후 식물생장상(DS-51GLP; Dasol Scientific, Hwaseong, Korea)에 옮겨주었다. 식물 생장상은 온도 20℃, 상대습도 60%, 기압 0.936 kPa(VPD), 광주기 12시간, 광원 fluorescent lamp, 광합성 유효 광양자속 밀도 PPFD 121±10µmol m-2 s-1의 조건을 유지하였다. 담액식(DFT) 수경재배(L×W×H, 32.5×22×23cm)을 이용하였고 지하부 산소 보충을 위해 산소발생기(air stone; Mimineaqua, Inchon, Korea)를 추가로 설치하였다. 양액은 1/2 호글랜드 양액(Hoagland와 Arnon, 1950)을 제조(EC: 1.0dS m-1, pH 6.0)하여 공급하였으며, EC 및 pH를 유지하기 위해 2주마다 교체하여 재배하였다.
2. 이산화탄소 처리 및 UV-A 처리
4주간 식물 생장상에서 키운 케일 잎의 두께를 변화시키기 위하여 다른 두 챔버로 케일을 각각 옮긴 후 10일간 CO2 농도를 처리하였다. 저농도 챔버(DS-51GLP; Dasol Scientific Co., Ltd., Hwaseong, Kore)의 CO2 농도는 382±3.2µmol mol-1으로 유지되었으며, 고농도 챔버(DS-51GLP; Dasol Scientific Co., Ltd., Hwaseong, Kore)의 CO2는 1,027±11.7 µmol mol-1으로 유지되었다. CO2농도는 식물 생장상 내 설치된 CO2 센서를 통해 설정 값에 따라 조절되었다. 10일간의 CO2 처리 후, UV 조사 시 잎 두께에 따른 반응을 확인하기 위하여 25.4W m-2의 UV-A LED(피크파장 370+385nm)를 5일간 동일한 광 조건(광원 및 광주기)에 보광(12 h day-1) 처리하였고, 이 때의 CO2는 추가적인 처리를 하지 않았으며, 대기중의 CO2농도로 유지되었다.
3. 생육 특성
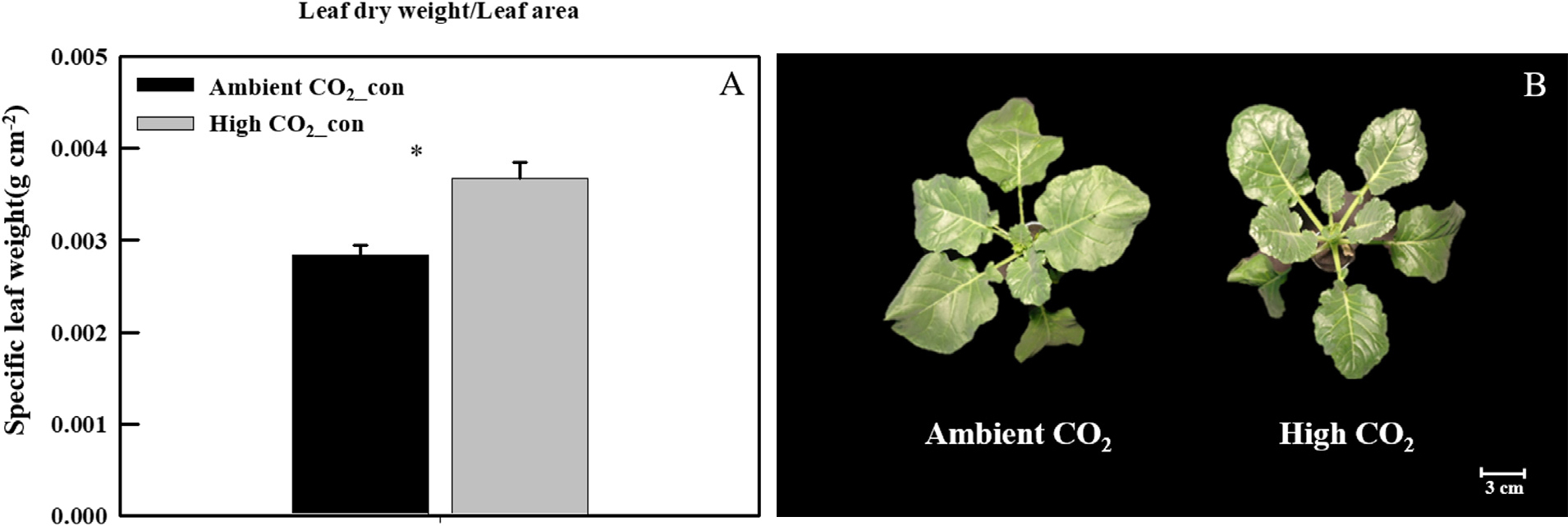
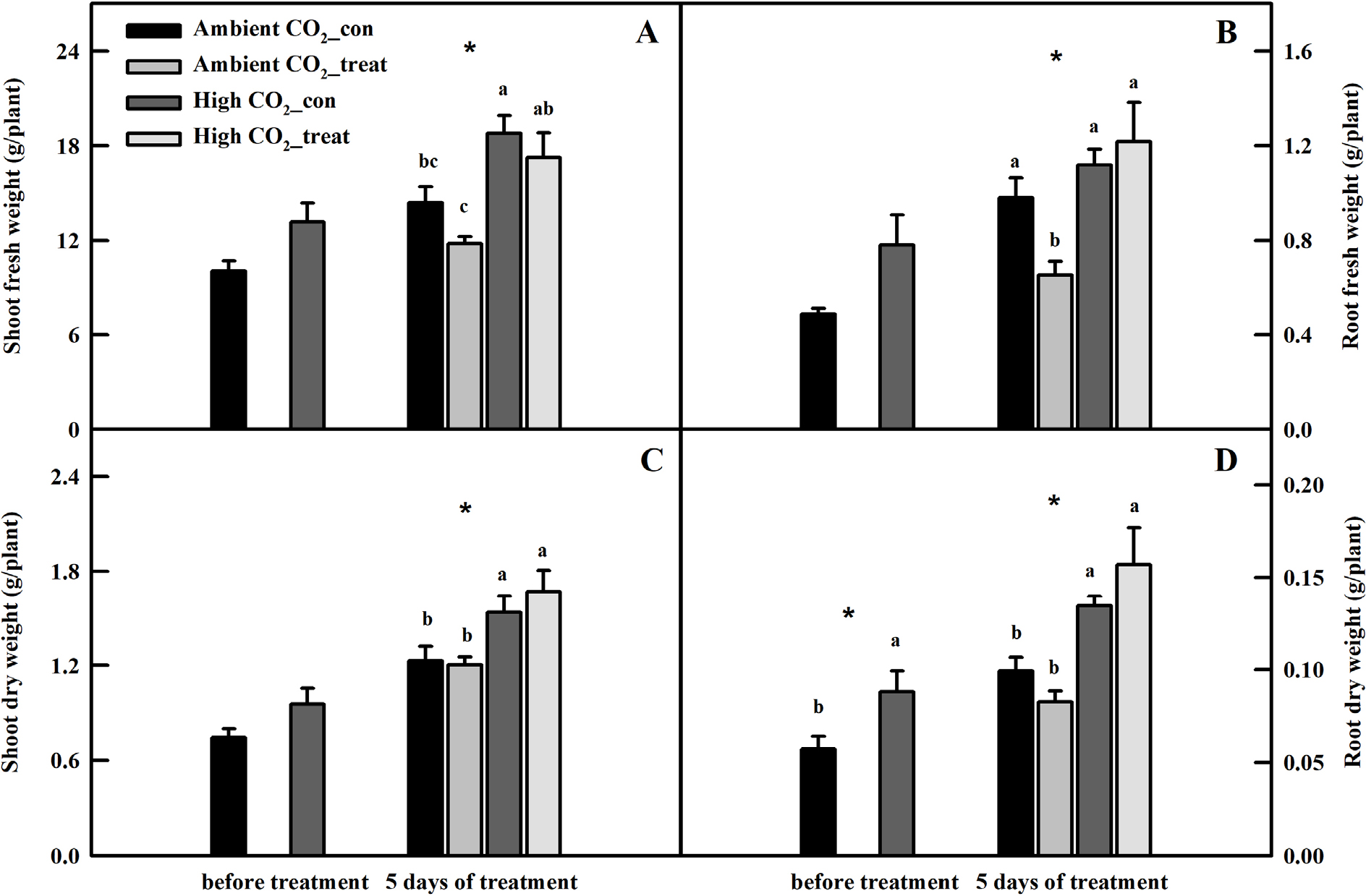
UV-A 처리 전, CO2 농도에 따른 케일의 잎 두께의 변화를 확인하기 위해, CO2 농도가 다른 환경에서 10일간 처리한 케일의 엽면적과 건물중을 측정하여 비엽중을 계산하였다. 엽면적은 엽면적계(LI-2050A; Li-Cor Lincoln, NE, USA)를 사용하여 측정하였고, 건물중은 70℃에서 72시간 이상 건조(VS-1202D3; Vision Scientific, Daejeon, Korea) 시킨 후에 전자저울(SI-234; Denver Instrument, Denver, CO, USA)을 사용하여 측정하였다. 비엽중은 SLW = Leaf dry weight(g)/Leaf area(cm2) 식을 이용하여 계산하였다. UV-A에 따른 식물의 생육 변화를 확인하기 위하여 UV처리 전과 처리 5일 후 지상부와 지하부의 생체중과 건물중을 측정하였다.
4. 광계II 최대 양자수율
UV광에 노출된 케일 잎의 스트레스 정도를 확인하기 위해 엽록소 형광 미터(PAM 2000; Heinz Walz GmbH, Effeltich, Germany)를 이용하여 광계II 최대 양자수율(Fv/Fm)를 측정하였다. 상부로부터 3번째 잎을 선택하여 측정하기 전 30분간 암적응 후, 포화 광 펄스(20kHz)인 1,100µmol m-2 s-1 PPFD을 잎에 조사하여 최대 형광값(Fm)과 최소 형광값(Fo)을 측정하여 Fv(Fm-Fo)를 구했다(Maxwell와 Johnson, 2000). 엽록소 형광 값은 처리구당 4반복으로 12시간 간격으로 측정하였다.
5. 생리활성 화합물 측정
5.1 총 페놀 함량과 항산화도
케일 잎의 총 페놀 함량과 항산화도는 FolinCiocalteu colorimetric 방법(Ainsworth와 Gillespie, 2007)과 2,2′-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS; Sigma-Aldrich, St. Louis, MO, USA) (Miller와 Rice-Evans, 1996) 방법을 사용하여 측정하였다. 케일 잎 시료(약 0.2g)를 액체질소와 함께 갈아 가루로 만든 뒤 3mL의 80%(v/v) 아세톤을 넣어 추출하였다. 2mL 마이크로 튜브에 추출액을 옮겨 담아 암조건에서 12시간 이상 냉장(4℃) 및 냉동(–20℃) 보관한 다음 원심분리(3,000×g, 2분)하여 얻은 상층액을 분석에 이용하였다. 이 후, 분석은 Lee 등(2019)의 설명에 따라 수행되었다. 총 페놀함량과 항산화도는 단위 생체중(g) 당 gallic acid equivalent(GAE)와 trolox(mM) equivalent antioxidant capacity(TEAC)로 각각 표현하였다.
5.2 개별적인 페놀 화합물 분석(고성능 액체 크로마토 그래피)
채취한 케일 잎 시료(약 0.5g)을 분석 전까지 –70℃의 초저온 냉동고에 보관하였다. 시료를 액체질소와 함께 갈아 분말화 한 뒤 5mL의 acidified acetonitrile(0.5% v/v HCL)을 넣고 추출하였다. 추출된 용액을 80℃ 항온 수조에서 가수분해 시킨 다음 30분 동안 초음파 처리(Sk5210HP; Hangzhou Nade Scientific Instruments, Zhejiang, China) 하였다. 추출 용액을 1,500×g에서 20분간 원심분리한 뒤, 상층액을 0.22μm 실린지 필터(Noble Bio, Hwaseong, Korea)로 여과시켰다. Agilent Eclipse Plus-C18(4.6mm×150mm, 5μm; Agilent Technology, Santa Clara, CA, USA)컬럼이 장착된 고성능 액체 크로마토 그래피 시스템(YL9100; Younglin, Anyang, Korea)을 이용하여 물질을 분리하였다. 컬럼의 온도는 30℃로 유지되었으며, 주입 용량은 10μL로 설정되었다. 이 후, HPLC분석은 Lee 등(2019)의 설명에 따라 수행되었다. 표준곡선은 HPLC grade의 caffeic acid(Sigma-Aldrich, St. Louis, MO, USA), ferulic acid(Sigma-Aldrich, St. Louis, MO, USA)를 사용하였으며, 단위는 생체중 당 mg 으로 표현되었다(100g)(mg 100g-1 FW).
6. 통계처리
생육 특성, 생리활성 물질(총 페놀함량, 항산화도, 개별적인 페놀 화합물 함량) 분석은 각 처리구별 5반복하였고, 광계Ⅱ 최대 양자수율(Fv/Fm)은 처리구별 4반복으로 12시간마다 측정되었다. 분산분석(Analysis of variance, ANOVA)을 수행하였고, 처리별 평균은 Student’s t-test(비엽중, 기능성 물질)와 Duncan’s multiple comparison(생육특성)를 이용하여 비교하였다. 모든 통계분석은 SAS(SAS 9.2; SAS Institute, Cary, NC, USA)를 이용하여 수행하였다.
결과 및 고찰
1. 이산화탄소 처리와 UV-A 조사에 따른 케일의 생육 특성
잎의 형태 구조적인 측면, 특히 잎 두께에 따라 UV-A 광 조사가 케일 잎의 2차 대사산물 축적 패턴에 어떠한 영향을 미치는지 확인하기 위해 4주간 동일한 환경 조건에서 재배된 케일을 CO2 농도가 다른 챔버(저농도 382.54±3.23µmol mol-1와 고농도 1,027.25±11.75µmol mol-1)로 10일간 옮겨주었다. 그 결과, 고농도의 CO2 환경에서 자란 케일의 잎의 두께(비엽중)가 저농도의 CO2 환경에서 자란 케일의 잎과 비교하였을 때 28% 유의적으로 증가하였다(Fig. 1A). 또한, 고농도의 CO2 환경에서 10일간 노출된 케일의 잎은 저농도의 CO2에서 재배된 식물과 비교했을 때, 잎 표면이 짙은 녹색을 띄고 광택을 나타냈다(Fig. 1B).
10일간 고농도의 CO2환경에 노출된 케일의 생육은 저농도 CO2에서 재배된 케일과 비교하였을 때 지상부와 지하부의 생체중과 건물중 모두 수치적인 증대가 관찰되었다(Fig. 2). 특히, UV-A 처리 전 저농도 CO2에서 자란 케일과 비교하였을 때 지하부 건물중이 54% 유의적으로 증대되었다(Fig. 2D).
잎 두께가 다른 케일에서 페놀릭 항산화 물질의 축적 패턴이 어떻게 변화되는지 확인하고자 UV-A LED를 5일간 보광 처리하였다. 그 결과, 지하부의 생체중을 제외하고는 저농도 그리고 고농도 CO2에서 자란 케일의 생육은 유의적인 차이를 보이지 않았다(Fig. 2). 지하부 생체중의 경우 저농도 CO2에서 UV-A가 처리된 식물은 49% 유의적인 감소가 관찰되었지만, 고농도 CO2에서 UV-A LED가 보광 처리된 식물은 8% 수치적인 증대가 관찰되었다(Fig. 2B).
이산화탄소 농도의 증가는 식물의 광합성, 대사 및 발달에 중요한 영향을 미치며, 대기 중 CO2양이 증가함에 따라 식물체의 크기와 생체량(biomass) 또한 증대될 수 있다(Farquhar 등, 1980; Ainsworth와 Long, 2005). 십자화과 Brassica속에 속하는 브로콜리, 콜리플라워, 케일, 순무, 유채, 흰겨자 식물 품종에 육묘 기간 동안의 CO2 시비는 식물의 광합성율을 증대시켰고 식물의 생육을 유의적으로 증대시켰다. 하지만, 장기간 1,000µmol mol-1에 노출은 대부분의 십자화과 식물 품종에서 광합성율을 감소시켰으며 그에 따라 생육 또한 유의적으로 감소되었다(Reekie 등, 1998). 우리의 결과에서도 육묘 단계의 케일에 10일간 단기간의 CO2처리는 식물 생육 증대에 효과가 있었다. 하지만, Reekie등(1998)의 연구와 같이, 고농도의 CO2 환경에서 장기간 노출은 오히려 광합성율의 감소를 유도하여 케일의 생육이 감소되었을 가능성이 존재한다.
잎의 형태 해부학적 특성은 온도, 광, 토양 수분 또는 대기 CO2 농도 와 같은 환경 요인에 대해 높은 반응성을 보이며, 생리적 기능과 관련된 잎의 구조 또한 환경에 따라 달라질 수 있다(Bahamonde 등, 2023). 더하여, 큐티클의 중요한 구성요소인 왁스의 구성과 양은 식물이 노출되는 환경 조건에 직접적으로 영향을 받아 변화된다(Bird와 Gray, 2003). 최근, Bahamonde 등(2023)의 연구는 상승된 CO2 조건 하에서 N. antarctica와 N. betuloides의 잎의 왁스 농도가 증가되고, 큐티클 구조 및 구성이 변화될 수 있다는 결과를 보고하였다. 우리의 연구에서도 고농도의 CO2 처리로 인해 잎의 왁스 농도가 증가되고 큐티클 구조 및 구성이 변화되어 잎 표면에 광택이 나타났을 가능성이 있다(Fig. 1B).
UV-A에 5일간 노출된 케일의 생육은 저농도 CO2에 UV-A가 처리된 케일의 지하부 생체중을 제외하고는 UV-A 처리에 의해 유의적으로 영향을 받지 않았다(Fig. 2). 이전 Krizek (2004)의 연구에 따르면, 청색(blue) 범위의 파장이 UV-B에 대한 DNA 손상을 복구 및 회복시키는데 효과적이라는 결과를 보고하였다(Krizek, 2004). 또한 최근 연구에서도 PAR조건 아래에서 UV-B보광은 몇몇 식물 종에서 순 광합성율을 증대시키고, UV-B 처리 전 또는 처리 후에 청색광의 노출은 UV에 의한 광합성 색소 분해를 억제시킬 수 있음이 보고되었다(Escobar-Bravo 등, 2017). 우리의 연구에서도 UV-A LED가 광주기 동안 보광 처리되었기 때문에 기존 형광등에 존재하는 청색광 파장이 UV에 의한 광합성 기구의 손상을 억제하여 생육에 악영향을 주지 않았을 가능성이 존재한다.
더하여, 높은 수준의 UV-A조사는 식물의 생장을 억제한다고 알려져 있으나(Krizek등, 1997), 낮은 수준의 UV-A 조사는 식물의 광합성율을 증대시키고 식물 생체량(biomass)를 유의적으로 증대시킬 수 있다고 보고되었다(Tsormpatsidis 등, 2008; Brazaitytė 등, 2015; Lee 등, 2019; Choi 등, 2022). 이전 연구에 따르면, 광 포화점에 도달하지 못하는 낮은 PPFD 조건에서 UV-A의 보광은 엽록소와 카로티노이드에 직접적인 빛 에너지로 흡수되고 궁극적으로 광합성 능력을 향상시킬 수 있음이 보고되었다(Verdagueret 등, 2017). 또한, 페놀릭 화합물과 같은 2차 대사산물에 의해 흡수된 UV-A 빛은 청록색(blue-green) 형광으로 여기되어 들뜬 전자가 간접적인 광합성 에너지로 사용될 수 있다(Mantha 등, 2001; Johnson와 Day, 2002). Lee 등(2019)의 연구에서도 370nm과 385nm의 피크 파장을 갖는 UV-A LED 보광 처리 아래에서 케일의 지상부와 지하부의 생체중 및 건물중이 유의적으로 증대되었고, 케일에 다양한 피크의 UV-A LED(365, 375, 385, 395 과 405nm)를 7일간 조사하였을 때 대조구와 비교하여 상대적으로 긴 파장을 갖는 395와 405nm의 UV-A LED에서 광합성율과 생장 매개 변수가 유의적으로 증대됨이 보고되었다(Choi 등, 2022). 우리의 연구에서도 식물 재배에 사용했던 형광등의 PPFD가 약 120µmol m-2 s-1로 우리가 사용한 케일의 광 포화점에 도달하지 못하였고(data not shown), 추가로 사용했던 UV-A LED의 파장 또한 상대적으로 긴 파장(피크파장 375+385nm)을 사용하였기 때문에 케일의 생육 감소에 큰 영향을 주지 않았을 가능성이 있다(Fig. 2).
2. 광계II 최대 광량자 수율(Fv/Fm)의 변화
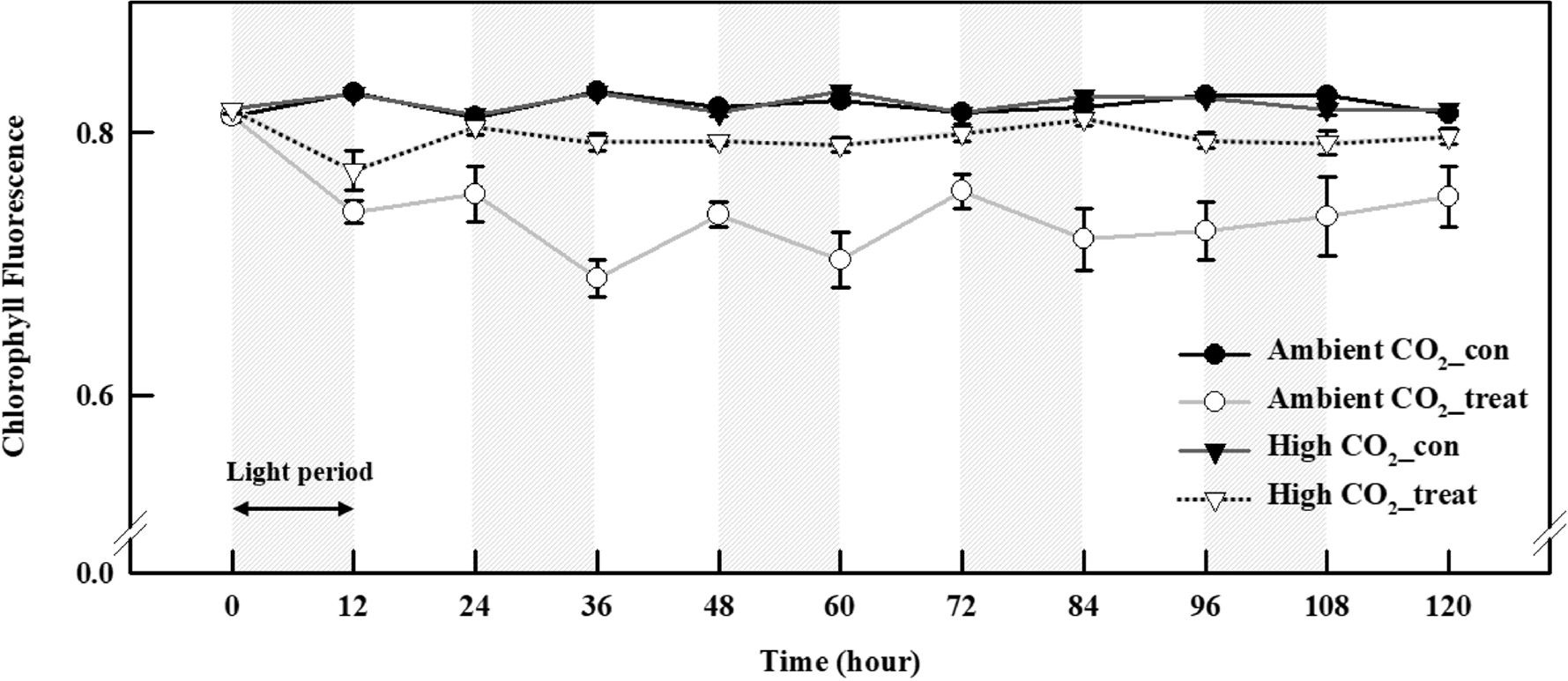
저농도(382±3.2µmol mol-1)와 고농도(1,027±11.7µmol mol-1)의 CO2에서 UV-A가 처리되지 않은 케일 잎의 Fv/Fm 값은 모두 0.81이상의 값을 나타내었다(Fig. 3). 하지만, CO2 시비 유무에 상관없이 UV-A가 처리된 케일의 Fv/Fm 값은 UV가 처리되지 않은 케일과 비교하여 뚜렷한 감소가 관찰되었다(Fig. 3). 저농도의 CO2에서 UV-A가 처리된 식물의 Fv/Fm 값은 UV-A LED처리 12시간 이후 빠르게 감소되어 0.74의 값을 나타내었고, 이후 24시간째 약간 증가하는 경향을 보이다가 36시간째에 0.68의 값을 보여 다시 감소하는 경향을 보였다. 36시간 이후에도 5일간의 UV-A 처리 동안 0.70-0.75의 값이 관찰되었다. 고농도의 CO2에서 UV-A LED에 노출된 케일 잎의 Fv/Fm 값 또한 UV 조사 12시간 이후 감소되었고(0.77), 대조구와 비교하였을 때 대체로 낮은 값을 나타내었다(Fig. 3).
광계Ⅱ(PSII)는 2개의 광 수확 복합체(light harvest complex)와 반응 중심 복합체(light reaction center)를 포함하는 틸라코이드 막의 광합성 단위로, 광계II는 외부 스트레스 요인에 가장 취약한 것으로 밝혀진 세포 구성 요소 중 하나이다(Allakhverdiev 등, 2008; Tyystjaervi 등, 2008). 광계Ⅱ의 최대 광효율을 의미하는 Fv/Fm 값은 식물의 광합성능력을 나타내는 민감한 지표로 값이 낮을수록 식물체는 스트레스 및/또는 광억제 환경에 노출되었음을 의미한다(Long 등, 1994; Maxwell와 Johnson, 2000). 정상적인 환경에서 자란 식물의 경우 Fv/Fm값은 대게 0.80-0.83의 범위를 나타낸다(Demimng와 Björkman, 1987). 하지만 UV 조사는 틸라코이드 막 단백질을 파괴하여 광계Ⅱ의 직접적인 손상을 야기하기 때문에, 높은 UV에너지에 노출된 식물의 Fv/Fm 값은 급격하게 감소된다(Schoedl 등, 2013; Yoon 등, 2020).
UV가 보광 처리되지 않은 저농도의 CO2 환경과 고농도의 CO2 환경에 노출된 케일의 Fv/Fm 값은 5일 동안 정상적인 수치를 기록하였다(Fig. 3). 하지만, 25W m-2의 UV-A LED에 노출된 케일 잎의 Fv/Fm값은 CO2의 시비 유무와 관계없이 UV에 노출되었을 때 급격하게 감소되어 스트레스를 받았음을 확인할 수 있었다(Fig. 3). 저농도의 CO2에 UV-A LED가 처리된 케일 잎의 Fv/Fm이 고농도의 CO2가 시비된 식물보다 더 급격한 감소가 관찰되었는데, 이러한 결과는 CO2 시비에 따른 생육 증대와 잎 세포 구조 및 구성의 변화에 기인한 결과일 수 있다(Figs. 1과 2). 식물은 UV의 방어수단으로 잎표면에 왁스물질을 만들며(Caldwell와 Britz, 2006), 해면조직의 두께를 증가시킨다고 알려져 있다(Kakani 등, 2003). 이전 연구에서도 백색광에 UV-A를 보광처리 하였을 때 잎 조직 층 중에서도 해면 조직의 두께가 유의적으로 증대되는 것이 보고되었다(Victorio 등, 2011). 이러한 연구결과를 토대로 고농도의 CO2 와 UV의 복합적인 작용으로 인해 잎이 상대적으로 비대해졌을 가능성이 있다. 즉, 잎 두께가 상대적으로 두꺼웠던 고농도의 CO2 조건에서는 UV-A 처리 동안 0.70-0.75사이의 Fv/Fm값을 보였고 저농도의 CO2 조건에서는 0.77-0.81의 사이의 값을 나타내어 상대적으로 잎이 얇은 케일(Ambient CO2_treat)이 UV에 대한 민감도가 높았을 가능성이 있다(Fig. 3).
또한, 저농도의 CO2에 UV-A를 조사를 시작하자 Fv/Fm값은 급격한 감소를 나타내다가 값이 다시 회복되는 경향을 보여 12시간 간격으로 상승과 하강을 반복하는 패턴을 나타내었다(Fig. 3). UV 처리 시간 기준으로 광주기가 끝나는 12, 36, 60, 84시간째에 Fv/Fm이 감소되었고 24, 48, 72, 96시간에 회복되는 경향을 보였다. 이것은 광 주기에 UV-A LED를 보광처리하여 나타난 결과로 볼 수 있다. 하지만, 고농도의 CO2에 UV-A가 조사된 잎에서는 광주기 유무에 상관없이 일정한 패턴을 나타내었는데, 이것은 고농도의 CO2 처리에 의해 두꺼워진 케일 잎이 UV침투를 억제하여 광계Ⅱ의 손상을 감소시켜 나타난 결과일 수 있다(Victorio 등, 2011).
3. 총 페놀 함량과 항산화도 및 개별적인 페놀 화합물의 변화
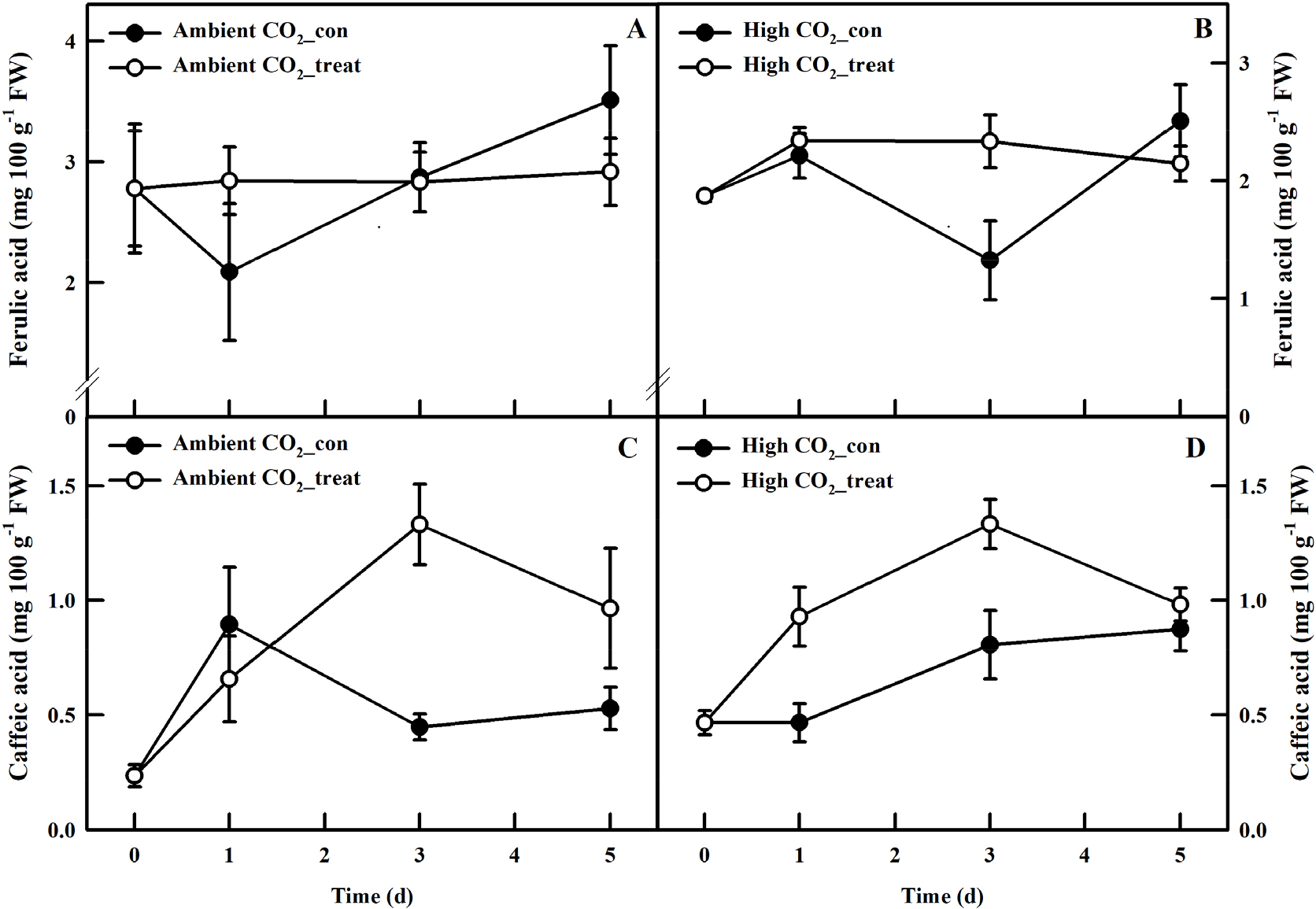
UV-A 처리는 저농도 그리고 고농도 CO2에서 재배된 케일 식물의 총 페놀 함량과 항산화도 증대 패턴의 변화를 유도하였다. 저농도의 CO2 환경에서 UV-A 처리 후, 1일차에 대조구와 비교하여 총 페놀 함량과 항산화도가 각각 20%과 17% 유의적으로 증대되었다(Figs. 4A와 4C). 저농도 CO2 조건에서 UV-A 처리 이후 대조구 식물과 UV-A 처리된 식물의 총 페놀 함량과 항산화도는 점진적으로 증가하는 추세를 보였지만 서로 유의적인 차이는 나타내지 않았다. 하지만, 고농도의 CO2 환경에서는 총 페놀 함량과 항산화도가 UV-A처리 3일차에 대조구와 비교하여 20%, 27% 각각 증대되는 경향을 보였지만 유의적인 차이는 보이지 않았다. Ferulic acid함량은 저농도와 고농도 CO2에서 UV-A에 노출된 케일 식물의 총 페놀 함량과 항산화도와 유사한 경향을 보였고, caffeic acid함량은 저농도와 고농도 CO2 조건 모두에서 3일째 높은 값을 나타내었지만 유의적인 차이는 관찰되지 않았다(Fig. 5).
일반적으로 높은 수준의 UV 조사는 단백질과 DNA뿐 아니라 광합성 기구에 직접적인 손상을 주어 식물 생장에 부정적인 영향을 미친다고 알려져 있다(Diffey, 1991). 하지만 식물은 과도한 UV조사에 대한 해로운 영향에 대응하기 위해 광 보호 메커니즘을 유도한다. 대표적인 광보호 메커니즘은 UV-흡수 페놀성 화합물(주로, hydroxycinnamic acids과 flavonoids)의 축적으로, 식물은 이를 통해 UV조사로부터 잎을 보호하는 역할을 한다(Shirley, 1996; Berli 등, 2010). 페놀성 화합물은 UV파장을 직접적으로 흡수하여 식물 조직 내부로의 직접적인 침투를 방지함과 동시에 높은 에너지를 갖는 UV 단파장을 장파장으로 변환시켜 세포 구조의 손상을 막는 역할을 한다(Bilger 등, 2001). 또한 잎에 축적되는 페놀성 화합물은 그 자체로 활성산소종(ROS)을 소거하는 항산화능을 가지고 있기 때문에 UV에 의한 산화적인 손상을 줄여줄 수 있다(Bilger 등, 2001). 우리의 결과에서도 UV-A LED가 보광 처리된 케일의 잎에서 CO2처리 유무에 상관없이 항산화적 페놀릭 화합물의 증대가 관찰되었다(Figs. 4와 5). 하지만 총 페놀 함량과 항산화도 축적 패턴이 CO2 처리 유무에 따라, 즉 잎 두께에 따라 다른 경향을 보였다. 저농도의 CO2농도에서 UV-A LED가 처리된 케일에서는 UV-A 처리 1일째에 총 페놀 함량과 항산화도가 증대되었고, 고농도의 CO2가 처리된 케일 잎에서는 UV-A 처리 3일째에 증대되었다(Fig. 3). 이러한 결과는 CO2처리에 의해 변화된 잎 두께에 따른 식물 생리학적 반응일 수 있다. 식물이 다양한 환경 스트레스에 노출되면 비구조적 탄수화물(가용성 당 및 전분)이 구조적인 역할을 하는 지질, 왁스 및 페놀과 같은 2차 대사산물로 우선적으로 분배되는데, 잎 수준에서 증가된 지질은 증산으로 인한 수분 손실을 줄이고 잎과 대기 사이의 가스 교환을 제어함으로써 환경 변화와 스트레스 요인으로부터 식물을 보호하는 중요한 역할을 한다(Schreiber 등, 2001; Scotti-Campos 등, 2019). Ofiti 등(2023) 또한 UV 스트레스가 식물의 비구조적 탄수화물 대사를 변화시켜 2차 대사산물로의 탄소 분배에 영향을 줄 수 있다고 보고하였다. 잎 두께가 더 얇았던 저농도 CO2에 UV-A LED가 처리된 케일 식물이 고농도 CO2에 UV-A LED가 처리된 식물 보다 UV-A광을 더 빠르게 스트레스 요인으로 인지하였고, 그 결과 보호 메커니즘으로써 비구조적 탄수화물을 2차 대사산물로 우선적으로 분배하였을 가능성이 존재한다. 저농도 CO2에 UV-A LED를 처리한 케일 잎의 Fv/Fm의 값이 고농도 CO2 케일 잎과 비교하여 UV조사 직후(12시간) 빠르게 감소하였는데(Fig. 3), 이러한 결과가 본 가설을 뒷받침할 수 있다. 따라서 잎이 얇은 케일(ambient CO2-treat) 식물에서는 총 페놀 함량과 항산화도 그리고 ferulic acid의 함량이 처리 1일째에 증대되었고(Figs. 4와 5), 높은 CO2 조건에서는 CO2와 UV-A LED의 상호작용이 케일 잎의 구조 형태적인 변화를 유도하여 UV에 대한 민감도를 낮추었기 때문에, 총 페놀 함량 그리고 항산화도가 UV처리 3일째에 증대되었을 가능성이 존재한다. Caretto 등(2015)은 1차 대사가 phenolic metabolites의 생합성을 위한 탄소 골격(carbon skeletons)을 제공하는 역할을 하며, 이는 비생물학적 그리고 생물학적 스트레스에 대한 신호 전달 및 방어 기능의 여러 측면에서 관여할 수 있다고 보고하였다. 또한, Lattanzio 등(2009)은 식물이 현재의 상태(식물 발달 및 대사)와 환경적 상황에 따라 제한된 자원을 성장과 방어(defense) 사이에서 할당하기 때문에 스트레스와 같은 환경 변화에 적응하여 식물 대사가 변화될 수 있다고 보고하였다. 즉, 높은 이산화탄소는 식물의 1차 대사산물 생합성에 영향을 미치므로 CO2와 UV와의 상호작용이 2차 대사산물(페놀릭 화합물) 축적에 어떠한 영향을 주는지에 대한 보다 심층적인 연구가 필요하다.
결 론
본 실험을 통해 UV조사에 의한 항산화적 페놀릭 화합물의 축적 패턴은 잎의 두께에 따라 달라질 수 있음을 확인하였다. 5일간의 UV-A LED보광처리는 케일 식물의 생육을 억제하지 않았으며 식물 생육 증대에 긍정적인 영향을 줄 수 있음을 확인하였다. 또한 5일간 UV-A LED 처리는 케일 식물 잎의 총 페놀 함량과 항산화도, caffeic acid 그리고 ferulic acid의 함량을 증대시켰다. 잎의 두께가 상대적으로 얇은 저농도(ambient CO2)의 케일에서는 항산화적 페놀릭 화합물이 UV 처리 1일째에 증대되었지만, 잎 두께가 두꺼운 고농도(high CO2)에서는 UV 처리 후 3일째에 증대되는 경향을 보였다. UV-A의 보광 처리는 케일과 같은 엽채소의 생육을 억제하지 않으면서 생리활성 물질을 향상시켜 고품질의 원예작물을 생산할 수 있는 가능성을 보여주었으며, 더 나아가 수확 전 elicitor로 UV를 보광 처리할 때에는 UV의 파장과 에너지(수준)뿐만 아니라 잎 두께(잎 형태-구조학적 특징)을 고려하여야 함을 시사한다. 하지만, 2차 대사산물의 생합성과 축적은 시간적, 공간적인 요인뿐만 아니라 복합적인 요인에 의해 영향을 받기 때문에 UV에너지와 생리활성 화합물의 축적 사이의 방어 메커니즘에 대한 보다 심층적인 연구가 필요하다.